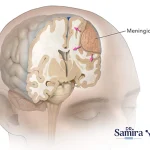
مننژیوم گرید یک یکی از شایع ترین تومورهای مغزی با منشا سلول های مننژ است که پوشش محافظ مغز و نخاع را تشکیل میدهند. اگرچه از لحاظ بیولوژیکی خوش خیم محسوب میشود، اما بسته به محل رشد آن در سیستم عصبی مرکزی، میتواند منجر به بروز علائم جدی نورولوژیک شود. درک دقیق ویژگی های بالینی، آسیب شناسی، پیشرفت بیماری، و استراتژی های درمانی برای مدیریت موثر آن ضروری است. در این مقاله به بررسی جامع این تومور، از منظر بالینی، مولکولی و درمانی پرداخته میشود.
چه کسانی در معرض ابتلا به مننژیوم گرید یک هستند؟
عوامل متعددی در بروز مننژیوم گرید یک دخیل هستند که ترکیبی از ژنتیک، جنسیت، سن و محیط را در بر میگیرد:
جنسیت: شیوع مننژیوم در زنان به طور چشمگیری بالاتر از مردان است (نسبت تقریبی 2:1 یا بیشتر). این تفاوت به تاثیرات هورمون های جنسی زنانه، به خصوص پروژسترون، نسبت داده شده است. بسیاری از مننژیوم ها گیرنده های پروژسترون را بیان میکنند.
سن: بیشترین شیوع در سنین میانسالی تا سالمندی گزارش شده است، خصوصا در افراد بالای ۶۵ سال.
پرتودرمانی در کودکی یا نوجوانی: مواجهه با اشعه یونیزان یکی از عوامل خطر اثبات شده برای بروز مننژیوم است. حتی دوزهای پایین در دوران کودکی میتوانند باعث افزایش خطر در آینده شوند.
بیماری های ژنتیکی خاص: نوروفیبروماتوز نوع ۲ (NF2) یکی از ناهنجاری های ژنتیکی مرتبط با بروز مننژیوم های متعدد، مخصوصا در جوانان است. جهش های ژن NF2 در این افراد منجر به اختلال در تنظیم رشد سلولی میشود.
عوامل احتمالی دیگر: مصرف هورمون ها (به طور مثال درمان جایگزین هورمونی)، سابقه خانوادگی تومورهای مغزی، و برخی مواجهات محیطی در حال بررسی هستند، اما هنوز شواهد قوی علمی در این زمینه وجود ندارد.
بیشتر بدانید: مننژیوم گرید ۳: تشخیص، ویژگی ها و روش های درمان
طبقه بندی پاتولوژیک مننژیوم گرید یک
سازمان بهداشت جهانی (WHO) تومورهای مننژیوم را به سه گرید اصلی تقسیم میکند:
- گرید I (خوش خیم)
- گرید II (غیر معمول، atypical)
- گرید III (بدخیم، آناپلاستیک)
مننژیوم گرید یک حدود ۸۰ تا ۹۰ درصد تمام موارد مننژیوم را تشکیل میدهد. در این گرید، سلول ها فاقد ویژگی های بدخیمی (مانند نرخ بالای میتوز، نکروز، آنیزوسیتوز، یا نفوذپذیری به بافت مجاور) هستند. شاخص میتوز اصولا کمتر از ۴ در هر ۱۰ میدان دید در بزرگنمایی بالا (HPF) است. از نظر بافت شناسی، گرید یک شامل ۹ زیر نوع مختلف است که عبارت اند از: مننگوتلیال، فیبروس، انتقالی (میکسویید)، پساموما توز، آنژیوماتوز، میکروسیتیک، سکرتوری، لنفوپلازماسیت ریچ، و متاپلاستیک.
بیشتر بدانید: مننژیوم آتیپیک یا گرید دو (Atypical Meningioma) چیست؟
مراحل پیشروی مننژیوم گرید یک
گرچه این تومور فاقد مراحل پیشروی تومورهای بدخیم مانند سرطان های متاستاتیک است، اما میتوان سیر بالینی آن را به سه مرحله عملکردی تقسیم کرد:
مرحله خاموش (Preclinical)
تومور وجود دارد اما به دلیل رشد آهسته و عدم فشرده سازی بافت های حیاتی مغزی، هیچ علامتی ایجاد نمیکند. در این مرحله اغلب با تصویربرداری های تصادفی کشف میشود.
مرحله علامت دار خفیف (Subclinical/Symptomatic)
با افزایش اندازه تومور، فشار موضعی بر بافت مغز یا اعصاب جمجمه ای ایجاد شده و علائم خفیف نظیر سردرد، اختلال تمرکز یا ضعف جزئی بروز میکند.
مرحله پیشرفته/فشاری (Progressive/Complicated)
در این مرحله تومور به حدی بزرگ شده که باعث ایجاد علائم شدید مثل تشنج، نارسایی حرکتی، یا اختلال شناختی واضح میشود. گاهی نیاز فوری به جراحی دارد.

علائم بالینی مننژیوم گرید یک
علائم بالینی مننژیوم گرید یک به محل تومور در مغز بستگی دارد. از آنجا که تومور رشد آهسته دارد، علائم به تدریج و طی ماه ها یا سال ها ظاهر میشوند. شایع ترین علائم عبارت اند از:
- سردرد: شایع ترین علامت اولیه، ناشی از افزایش فشار داخل جمجمه ای یا تحریک مننژها.
- تشنج: به ویژه در تومورهای ناحیه فرونتال یا تمپورال که اغلب به صورت پارشیال شروع میشود.
- تغییرات شناختی یا رفتاری: از جمله کاهش حافظه، عدم تمرکز، یا تحریک پذیری.
- ضعف اندام ها: در صورت درگیری قشر حرکتی.
- اختلال بینایی یا شنوایی: به خصوص در مننژیوم های قاعده جمجمه.
- اختلال در تعادل و هماهنگی: در صورت فشار بر مخچه یا ساقه مغز.
- تورم عصب بینایی (پاپیلوادم) در موارد افزایش ICP.
بیشتر بدانید: سرطان پوست چگونه به وجود میآید؟
ویژگی های مولکولی و ژنتیکی مننژیوم گرید یک
مننژیوم گرید یک در سطح ژنتیکی و مولکولی تفاوت هایی با گریدهای بالاتر دارد. از جمله تغییرات رایج عبارت اند از:
- حذف کروموزوم ۲۲q و ژن NF2 (بیش از ۶۰٪ موارد)
- موتاسیون در ژن های TRAF7، KLF4، SMO و AKT1
- بیان گیرنده های پروژسترون و آندروژن در برخی زیرگونه ها
این ویژگی ها میتوانند به شناسایی زیرگروه های توموری، پیش بینی رفتار بالینی، و حتی انتخاب درمان هدفمند کمک کنند. به عنوان مثال، موتاسیون AKT1 E17K با پاسخ به مهارکننده های مسیر PI3K/AKT در مطالعات بالینی مرتبط بوده است.
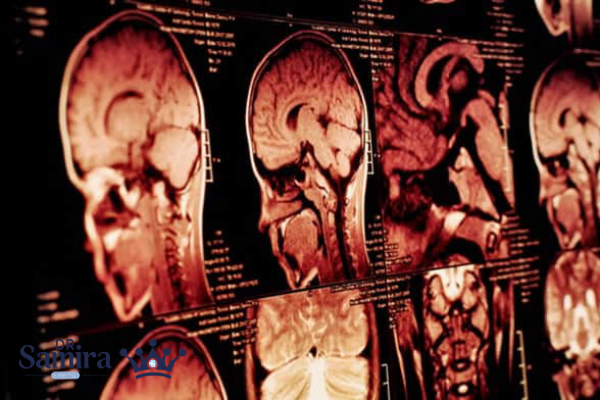
روش تشخیص مننژیوم گرید 1
تشخیص مننژیوم گرید یک به مجموعه ای از یافته های بالینی، تصویربرداری، و بررسی بافت شناسی نیاز دارد:
MRI با گادولینیوم
ابزار تصویربرداری استاندارد، تومور اغلب به صورت ضایعه با حاشیه واضح و جذب کنتراست یکنواخت دیده میشود.
CT اسکن
در تشخیص کلسیفیکاسیون و درگیری استخوان های جمجمه مفید است.
بیوپسی و بررسی پاتولوژیک
تشخیص نهایی بر اساس هیستوپاتولوژی صورت میگیرد.
راه های درمان مننژیوم گرید یک
استراتژی درمانی بسته به اندازه، محل، علائم و وضعیت عمومی بیمار انتخاب میشود.
درمان انتظاری
در موارد بدون علامت، کوچک، و در افراد مسن، نظارت دوره ای با MRI به جای درمان تهاجمی توصیه میشود.
جراحی
درمان اصلی مننژیوم گرید یک برداشت کامل تومور از طریق جراحی است. موفقیت جراحی به محل تومور و میزان دسترسی جراح ماهر مانند دکتر سمیرا خالدی متخصص رادیوتراپی و انکولوژی وابسته است. درجه برداشتن جراحی بر اساس معیار «سیمپسون» سنجیده میشود.
پرتودرمانی
در مواردی که جراحی امکان پذیر نیست یا تومور پس از جراحی عود کند، از رادیوتراپی هدایت شده یا رادیوسرجری استریوتاکتیک
یک (SRS) استفاده میشود.
درمان دارویی
در حال حاضر، داروهای سیستمیک نقش محدودی در درمان مننژیوم گرید یک دارند. با این حال، در صورت وجود موتاسیون های خاص مانند AKT1 یا SMO، داروهای هدفمند در کارآزمایی های بالینی استفاده میشوند.
پیشگیری مننژیوم گرید یک
مننژیوم گرید یک در صورت برداشتن کامل و عدم وجود عوامل خطر مولکولی، پیش آگهی بسیار خوبی دارد:
- نرخ بقای ۵ ساله بیش از ۹۵٪
- عود کمتر از ۱۰٪ در موارد با جراحی کامل
پیشنهاد میشود که بیماران پس از جراحی به صورت سالانه با MRI پیگیری شوند. در صورت عدم عود در ۵ سال اول، میتوان فواصل پیگیری را به هر دو سال یک بار افزایش داد.
نتیجه مطالب …
مننژیوم گرید یک توموری با سیر بالینی آهسته و پیش آگهی مطلوب است، اما در صورت بی توجهی به محل تومور یا تاخیر در تشخیص میتواند عوارض قابل توجهی ایجاد کند. انتخاب روش درمانی مناسب، نظارت منظم و توجه به ویژگی های مولکولی برای مدیریت موفق این بیماران ضروری است. پژوهش های آینده، افق های جدیدی را برای درمان اختصاصی تر و شخصی سازی شده تر فراهم خواهند کرد.